近日,《国际生物科学杂志》(International Journal of Biological Sciences)(IF:10.75;JCR1区期刊)以Research Article形式在线发布了中南大学湘雅医院神经内科主任、国家老年疾病临床医学研究中心(湘雅医院)副主任沈璐教授团队,运动系统损伤修复研究中心主任、国家老年疾病临床医学研究中心(湘雅医院)老年骨关节疾病研究所副所长谢辉教授团队题为“Brain-derived extracellular vesicles promote bone-fat imbalance in Alzheimer's disease”(脑源性胞外囊泡促进阿尔茨海默病的骨脂失衡;doi: 10.7150/ijbs.79461)的最新研究成果。该研究发现miR-483-5p通过下调Igf2介导阿尔茨海默病(AD)脑源性胞外囊泡(EVs)诱发骨脂失衡,导致骨质疏松症(OP)。中南大学湘雅医院神经内科主任沈璐教授、运动系统损伤修复研究中心主任谢辉教授和王振兴副研究员为该论文共同通讯作者,刘希希助理研究员和陈春媛特聘副研究员为共同第一作者,江亚凌博士、万枚丹博士和饶珊珊助理研究员等为该论文的重要参与作者。中南大学湘雅医院为该论文第一作者兼通讯作者单位。

随着全球人口预期寿命的延长,与年龄相关的疾病越来越成为公共卫生的重大挑战。AD是老年期痴呆最常见的类型,是一种以进行性认知功能障碍为特征的神经退行性疾病。由β淀粉样蛋白(Aβ)聚集形成的细胞外淀粉样斑块和由异常磷酸化的tau蛋白形成的胞内神经元纤维缠结是AD的主要病理特征。OP是常见的骨退行性疾病,其特征是骨量降低、骨微结构破坏和骨髓脂肪堆积等。骨髓间质干细胞(BMSCs)的成骨不足和成脂过度被认为是OP发病的关键因素。流行病学研究表明,AD患者更容易发生OP。然而,在AD病理条件下,调控BMSCs的命运并诱发OP的机制尚不明确。
沈璐教授、谢辉教授团队的研究首先发现AD或野生型小鼠的脑源性胞外囊泡可以穿过血脑屏障到达远端骨组织。研究发现,AD脑源性EVs和AD患者的血浆EVs均显著抑制BMSCs的成骨分化,并促进其成脂分化,诱发骨丢失和骨髓腔脂肪堆积。进一步研究揭示了miR-483-5p在AD小鼠脑组织、AD脑源性EVs以及AD患者血浆EVs中高度富集。机制研究探明AD脑源性EVs转运的miR-483-5p通过下调Igf2诱导BMSC成骨成脂分化失衡,从而促进OP的发生。
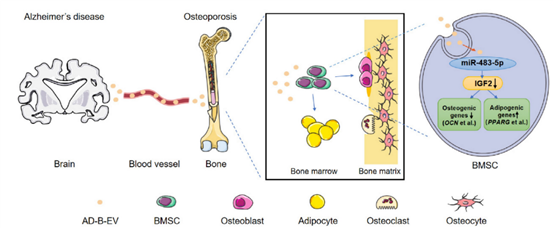
AD脑源性EVs调节BMSCs成骨成脂分化命运并诱导骨质流失和骨髓脂肪堆积的模式图。
该研究揭示了AD脑源性EVs介导的“脑-骨轴”加重OP的机制(图1),为老年期AD和OP疾病的防治提供了新思路。此前,团队还报道了年轻骨细胞来源的胞外囊泡(OCY-EVs)可进入脑中改善AD小鼠的认知功能,率先揭示了“骨-脑轴”信息传递参与AD调控(Adv Sci. 2022 Jun; 9: e2105316. doi: 10.1002/advs.202105316)。骨骼系统和神经系统退行性疾病形成了一种恶行循环,如何阻断该循环进而改善AD和OP有待深入探索。
原文链接:https://www.ijbs.com/v19p2409.htm



